Acide ribonucléique ribosomique
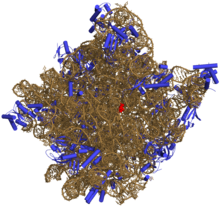
Les protéines sont colorées en bleu et les ARN en orange. Le site actif, l'adénine 2486 est coloré en rouge
L'ARN ribosomique (ARNr) ou ARN ribosomal par anglicisme (ribosomal RNA, rRNA, en anglais) est le constituant principal des ribosomes, auxquels il donne leur nom.
Les différents ARNr sont à la fois l'ossature et le cœur du ribosome, un complexe ribonucléoprotéique (composé de protéines et d'ARN) servant à la traduction de l'information génétique codée sur un ARN messager (ARNm). Celui-ci est issu de la transcription d'une portion du génome, à partir de laquelle il synthétise les protéines au sein de la cellule. En plus des ARNr, le ribosome est constitué d'une cinquantaine de protéines appelées protéines ribosomiques.
Les ARN ribosomiques sont eux-mêmes produits à partir de gènes codés dans l'ADN. Ils sont transcrits sous forme de précurseurs plus longs qui sont ensuite clivés pour donner les différents ARNr. Chez les eucaryotes, ce processus de maturation/clivage se déroule dans le nucléole. À partir des ribosomes situés dans le cytosol, les ARNr sont repliés sur eux-mêmes, formant une structure tridimensionnelle compacte. Cette structure protège les ARNr, qui sont très stables, par opposition aux ARN messagers qui ont en général une durée de vie courte.
Synthèse
[modifier | modifier le code]Eucaryotes
[modifier | modifier le code]Chez les eucaryotes, l'ARN polymérase I effectue la transcription de précurseur d'ARN 5,8S, 18S et 28S (précurseur 45S) qui sont ensuite maturés en subissant différentes modifications chimiques.
Il est ensuite clivé par les snoRNP (small nucleosomal RiboNucleoProtein ou « Petite ribonucléoprotéine nucléosomique »), qui sont des complexes ribonucléoprotéiques (des complexes formés d'acide ribonucléique et de protéines).
Comme la plupart des ARN, l'ARN ribosomique est codé par des gènes. Il en existe de nombreuses copies dans le génome (200) situées dans le nucléole sur 5 chromosome acrocentriques. Les gènes codant les ARNs sont disposés en paires, et comme chez les procaryotes, séparés par les Espaceurs Non Transcrits, des régions d'ADN qui ne codent pas.
Procaryotes
[modifier | modifier le code]Composition
[modifier | modifier le code]Eucaryotes
[modifier | modifier le code]- La grande sous-unité ribosomique 60S des eucaryotes est composée de 49 protéines et des ARNr suivants :
- La petite sous-unité ribosomique 40S est composée de 33 protéines et d'un ARNr :
- ARNr 18S (1 869 nucléotides chez l'homme).
Les ARNr 28S, ARNr 5,8S et ARNr 18S sont synthétisés dans le nucléole tandis que l'ARNr 5S est synthétisé à l'extérieur du nucléole, dans le nucléoplasme, mais toujours dans le noyau.
L'unité S est le symbole de Svedberg qui correspond à une constante de sédimentation.
Cas particulier de l'ARNr 5,8S des Diptères[1]
[modifier | modifier le code]Chez les insectes de l'ordre des diptères, la région de l'ARNr 5,8S se présente en deux sous-unités au lieu d'une : l'ARNr 5,8S (123 nucléotides chez la drosophile) et l'ARNr 2S (30 nucléotides chez la drosophile). La sous-unité 2S n'est toutefois pas présente chez les moustiques qui possèdent comme la majorité des Eucaryotes une seule région (environ 154 nucléotides).
Procaryotes
[modifier | modifier le code]- La grande sous-unité ribosomique 50S des procaryotes contient les ARNr suivants :
- La petite sous-unité ribosomique 30S contient l'ARNr suivant :
Fonctions des différents ARNr
[modifier | modifier le code]ARNr de la petite sous-unité (16S ou 18S)
[modifier | modifier le code]L'ARN de la petite sous-unité est impliqué dans la lecture de l'ARN messager. C'est lui qui vérifie que l'interaction entre le codon situé dans le site A du ribosome et l'anticodon de l'ARNt est correcte. L'ARN de la petite sous-unité est donc le contrôleur de la fidélité de la traduction en protéine du message génétique.
ARNr de la grande sous-unité (23S ou 28S)
[modifier | modifier le code]Le grand ARN de la grande sous-unité du ribosome est impliqué dans la formation des liaisons peptidiques. C'est lui qui est le catalyseur direct de la biosynthèse des protéines. Le centre actif du ribosome, appelé peptidyltransférase, est constitué exclusivement d'ARN ribosomique. La structure cristallographique du ribosome a montré qu'il n'y avait pas de protéine à moins de 50 à 60 Å de ce site actif. L'ARNr de la grande sous-unité est donc un ribozyme[4].
ARNr et antibiotiques
[modifier | modifier le code]Les ARN ribosomiques bactériens (procaryotes) sont la cible de près de la moitié des antibiotiques utilisés en thérapeutique humaine ou vétérinaire. Ces antibiotiques, pour la plupart dérivés de produits naturels, agissent soit en bloquant la traduction, soit en faisant faire des erreurs au ribosome.
Principales familles d'antibiotiques agissant sur l'ARNr :
- ARNr 16S : aminoglycosides (gentamicine, amikacine, isépamicine), tétracyclines, phénicols. Ces antibiotiques agissent sur la fidélité de lecture du ribosome. En provoquant des erreurs, ils provoquent la synthèse de protéines anormales dont l'accumulation finit par être létale ;
- ARNr 23S : macrolides (érythromycine, azithromycine), kétolides (télithromycine (en)), oxazolidinones (en) (linézolide). Ces antibiotiques agissent en perturbant la synthèse de la liaison peptidique.
ARN ribosomique et évolution
[modifier | modifier le code]L'ARN de la petite sous-unité du ribosome est une molécule dont la séquence est très utilisée pour faire des études de phylogénie au moyen d'outils bio-informatiques. On la trouve conservée dans l'ensemble des organismes vivants. En comparant les séquences du gène de cet ARN chez différentes espèces, il est possible d'évaluer leur parenté évolutive. La base de données du « Ribosomal database project » rdp.cme.msu.edu recense les séquences de l'ARN ribosomique 16S ou 18S de plus de 270 000 espèces vivantes. Ces données permettent de reconstituer un arbre phylogénétique des espèces.
Notes et références
[modifier | modifier le code]- G. Witzany, « Noncoding RNAs: Persistent Viral Agents as Modular Tools for Cellular Needs », Ann. N. Y. Acad. Sci., vol. 1178, pages 244-267, 2009.
- T. Shimada, « Distribution of split 5.8S ribosomal RNA in Diptera », Insect Molecular Biology, vol. 1, no 1, , p. 45–48 (ISSN 0962-1075 et 1365-2583, DOI 10.1111/j.1365-2583.1993.tb00076.x, lire en ligne, consulté le )
- J. Brosius, T. J. Dull et H. F. Noller, « Complete nucleotide sequence of a 23S ribosomal RNA gene from Escherichia coli », Proceedings of the National Academy of Sciences of the United States of America, vol. 77, , p. 201–204 (ISSN 0027-8424, lire en ligne, consulté le )
- J. Brosius, M. L. Palmer, P. J. Kennedy et H. F. Noller, « Complete nucleotide sequence of a 16S ribosomal RNA gene from Escherichia coli », Proceedings of the National Academy of Sciences of the United States of America, vol. 75, , p. 4801–4805 (ISSN 0027-8424, lire en ligne, consulté le )
- P. Nissen, J. Hansen, N. Ban et P. B. Moore, « The structural basis of ribosome activity in peptide bond synthesis », Science (New York, N.Y.), vol. 289, , p. 920–930 (ISSN 0036-8075, lire en ligne, consulté le )
